Маленький мальчик у соседей получил к Новому году в подарок металлический конструктор. Целый день он играет с этим конструктором, состоящим из большого числа различных деталей: винтов, кружков, угольников, зубчатых колёс и т.п., из которых он конструирует машины, велосипеды и краны. Когда ему надоедает какая-нибудь модель, то ему приходится затрачивать много труда, чтобы её снова разобрать. Конечно, ему удаётся разобрать модель только до отдельных деталей — колёс, длинных полосок и пластинок.
Дальнейшее разъединение за пределы этих отдельных деталей становится для него уже невозможным. При помощи ножниц для резки металла или острых щипцов, конечно, возможно было бы разрезать также и эти детали на более мелкие куски, но тем самым весь комплект конструктора был бы нарушен, ибо полученные при этом малые куски уже невозможно было бы снова использовать в качестве строительных частей.
Таким образом, отдельные детали ящика с «конструктором» образуют как бы «строительные кирпичики», из которых можно составить различные модели. С другой стороны, эти детали представляют собой также и тот предел, до которого разборка модели является разумной и целесообразной. Число деталей остаётся при нормальных условиях всегда одним и тем же, но формы предметов, сконструированных из этих деталей, могут изменяться.
- Элементы
- Примечание:
- Содержание химических элементов в земной коре
- Химические элементы и строение Земли
- Древние философы
- Зарождение современного представления о химических элементах
- Атомы
- До каких пределов можно делить гвоздь?
- Предел делимости вещества. Исторический аспект
- Открытие атома
- Закон постоянных весовых отношений Дальтона
- Литература:
Элементы
Применим наш пример к веществам. И в этом случае мы имеем дело с такими «строительными кирпичиками» или элементами, из которых построено всё разнообразие материального мира. Выбрав себе какое-нибудь вещество, мы можем его при помощи химического воздействия разделить на более простые составные части, что иногда удаётся сделать легко, а иногда довольно трудно. Эти части могут быть разложены и далее на более простые части, но в конце концов в этих операциях мы подойдём к пределу: дойдём до веществ, которые уже нельзя будет химическим путём расщепить на ещё менее сложные части. Они, следовательно, будут представлять собой основные вещества, элементы, на которые данное вещество может быть разложено и из которых, с другой стороны, снова может быть построено сложное вещество.
Мы обозначаем словом элемент такие вещества, которые уже не могут быть путем химических воздействий разложены на более простые составные части. Здесь следует подчеркнуть слова «путём химического воздействия». Физическим путём дальнейшее разделение элементов оказывается возможным. Однако для этого недостаточно действия тех сил, которые применяются при проведении химических реакций. Вместе с тем такое расщепление элемента означало бы и разрушение вещества.
В противоположность непрерывно увеличивающемуся числу химических соединений число элементов сравнительно невелико. Ещё в 50-х годах ХХ века число известных элементов было равно 92, а в настоящее время (на 2020 г.), открыто 118. Чем тяжелее элемент, тем он обыкновенно и менее устойчив и менее долговечен. Из новооткрытых трансурановых элементов некоторые имеют очень короткую продолжительность жизни.
Большинство элементов представляют собой металлы. В то время как металлы, за исключением ртути, являются твёрдыми телами, неметаллы при нормальной температуре встречаются в твёрдом, жидком и газообразном агрегатном состоянии.
Примечание:
При обычных условиях все неметаллы — твёрдые или газообразные вещества. Лишь один бром представляет исключение, что дало повод Баляру, открывшему бром, заявить: «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл».
И без того незначительное число элементов сократится ещё в значительной степени, если мы будем иметь в виду только те элементы, которые в природе играют по их количественному содержанию более или менее существенную роль. Из их числа мы можем назвать двенадцать элементов, которые составляют 99.5% веса всей земной коры и окружающей её атмосферы.
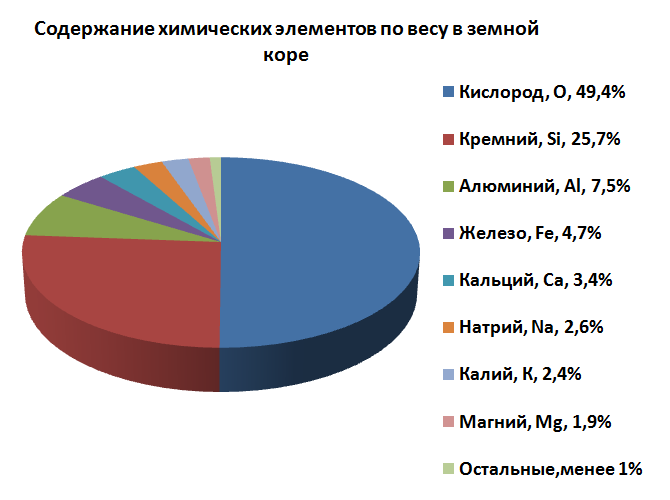
Содержание химических элементов в земной коре
На первом месте стоит кислород, невидимый для нас элемент, присутствующий в земной коре и в атмосфере в количестве 49.4%. Ему принадлежит львиная доля массы всех элементов земной коры. Это станет вполне понятным, если мы учтём, что не только в среднем 20% атмосферы состоит из кислорода, но что он, будучи соединён с водородом, покрывает в виде воды 71% поверхности земного шара, а в составе воды содержится в количестве около 90% по весу. Наконец, кислород содержится в химически связанном виде почти во всех минералах.
Второе место занимает встречающийся в природе только в виде соединений в количестве 25.7%всей массы земной коры кремний. Затем следуют на далёком расстоянии алюминий в количестве 7.5%, железо — 4.7%, кальций — 3.4%, натрий — 2.6%, калий — 2.4%, магний — 1.9%. Доля участия остальных элементов в составе земной коры не превышает 1%.
Просуммировав процентное содержание первых 36 основных веществ, мы получим 99.99%. Долю участия в земной коре остальных элементов, вместе взятых, приходится оценивать только цифрой 0.01 % от всего веса земной коры. Среди этих остальных элементов необходимо назвать такие важные, как олово, уран, йод, золото и висмут, для которых мы могли бы ожидать несколько большей доли их участия в составе земной коры.
Химические элементы и строение Земли
Как уже было сказано, эти цифры относятся к известной нам лишь, до определённой глубины массе земной коры, которая представляет только некоторую долю массы всего земного шара. Если бы мы могли принять во внимание всю массу земного шара, с точки зрения её состава, и расположить элементы в таблицу по их количественному содержанию, с точки зрения их участия в построении целого земного шара, то такая таблица значительно отличалась бы в отношении последовательности элементов, обозначенных в первой таблице. В этой таблице на первые места выдвинулись бы скорее тяжелые металлы.
В пользу такого заключения свидетельствуют многие основания. Если продавец всовывает вам в руку запечатанную пачку папирос, то вы рассчитываю во всяком случае, что вес её будет приблизительно равен пятидесяти граммам. Но если вы неожиданно с удивлением убедитесь в том, что пачка весит полкилограмма, то вполне добросовестно сможете утверждать, что в пачке заключается нечто иное, а не папиросы, и для этого нет надобности вскрывать пачку. Может быть, в ней находится свинец или какое-либо другое тяжелое вещество, но во всяком случае не те тлеющие табачные стержни, которые вы в ней надеялся найти.
Так дело обстоит и с нашим земным шаром. Путём измерения силы тяжести было установлено, что удельный вес (в настоящее время больше применяется понятие «плотность») земного шара равен 5.6. Однако удельный вес земной коры равен только 2.6, т.е. он даже меньше половины удельного веса всего земного шара. На основании этого мы, несомненно, имеем право сделать заключение о том, что внутренняя часть земного шара должна быть значительно тяжелее, чем его кора, другими словами, в центре земного шара должны присутствовать преимущественно тяжелые элементы. К тому же выводу мы придём на основании изучения землетрясений и на основании исследований истории Земли.
В настоящее время мы себе представляем, что Земля построена из отдельных слоёв, в которых преимущественно присутствуют отдельные элементы. Правда, эти слои отграничиваются друг от друга не так гладко и отчетливо, как, например, слои луковицы, в виде которой для простоты и изображают земной шар. Самый внутренний слой, т.е. ядро Земли, состоит, по мнению геофизиков, главным образом из никеля (лат. niccolum) и железа (лат. ferrum), почему этому ядру и присвоено название нифе (Nife). В дальнейших слоях затем содержатся всё более и более лёгкие элементы и соответствующие им соединения.

Представление о том, что множество веществ можно свести к некоторым простым веществам, так же старо, как борьба человека за истолкование явлений природы.
Древние философы
За 600 лет до нашей эры в Милете (малая Азия) жил философ по имени Фалес, который понял, какую огромную роль играет вода как в мёртвой, так и в живой природе. Вода в виде морей, озёр и рек покрывает большую часть поверхности Земли, она поднимает корабли, двигает жернова мельниц, прорывает плотины. В своих различных формах в виде жидкости, льда и пара она служит человеку. Каждое животное, каждое растение нуждается в воде. Человек может переносить голод дольше, чем жажду. При отсутствии воды в течение продолжительного времени смерть человека неизбежна. Плодородные пашни превращаются без воды в бесплодные пустыни. Не удивительно поэтому, что Фалес видел в воде начало всех элементов, первичный элемент, из которого образуются все вещества и к которому они вновь возвращаются.
Другой философ Анаксимен видел этот первичный элемент в окружающем все предметы воздухе, в то время как Гераклит считал огонь важнейшим первичным началом всех вещей.
Пять элементов, а именно: воду, огонь, дерево, золото и землю, насчитывали уже за 600 лет до нашей эры китайцы, а индусы признавали четыре элемента, к которым позднее был присоединён пятый, а именно духовное начало. Взгляды индусов, вероятно, предшествовали воззрениям греческого философа Эмпедокла (490—430 гг. до н.э.), который относил к элементам воду, землю, огонь и воздух.
Аристотель (384—322 гг. до н.э.) перенимает это число четыре, однако согласно его учению мир состоит из первичного вещества (начала) и из четырёх основных свойств, а именно: теплоты, холода, сухости и влажности. Первичное вещество всегда связано с двумя свойствами из этих четырёх, причём теплота и холод, а также сухость и влажность взаимно исключают друг друга. Таким образом и возникают четыре элемента по Аристотелю:
— огонь — первичное начало (теплота и сухость);
— вода — первичное начало (влажность и холод);
— воздух — первичное начало (теплота и влажность);
— земля — первичное начало (холод и сухость).

Это учение о четырёх элементах было распространено в течение продолжительного времени, и оно оказало очень сильное влияние на химию древнего мира и средних веков. На Аристотеля ссылались Алхимики, когда они непрерывно старались отыскать «камень мудрецов» и получить из неблагородных металлов золото. Они были убеждены, что ввиду того что все элементы имеют общее начало и отличаются друг от друга только неодинаковыми сочетаниями переменных свойств, достаточно только заменить одни свойства другими, и удастся по желанию изменить и самые вещества.
Если и сам Аристотель усматривал в эфире существование ещё одного дополнительного, духовного элемента, то алхимиков ещё в меньшей степени могли удовлетворять четыре элемента древности. У них появляются дополнительные элементы — ртуть, сера и соль. Однако они понимали эти вещества не так, как на них смотрим мы в настоящее время: для них эти элементы являлись лишь вещественными носителями свойств, которые в веществах вместе со старыми аристотелевскими свойствами содержатся в переменных сочетаниях. В то время как ртуть имеет металлический характер, соль олицетворяет солеобразные вещества, а сера — горючее начало.
Зарождение современного представления о химических элементах
Только Иоахим Юнгиус и Роберт Бойль создали во второй половине XVII века то принимаемое и поныне понятие об элементе, согласно которому элементы представляют собой простые вещества, которые уже не могут быть химическим путём расщеплены на ещё более простые вещества.
В особенности Роберт Бойль проложил пути для дальнейшего развития понятия об элементах.
Правда, Бойль ещё не различал понятие «элемент», от понятия «простое вещество», ибо ему, как и его современникам, не хватало для этого экспериментальных возможностей. Лишь в следующем столетии благодаря применению весов и возросшему опытному материалу стало возможным всё более и более чёткое разграничение понятий «элемент» и «соединение».
Этот путь привёл в дальнейшее время к открытию неизвестных элементов, к установлению периодической системы элементов, к получению трансурановых элементов, из которых некоторые даже и вовсе не были обнаружены в природе. Таким образом была создана объемлющая теория элементов,которая позволяет нам в настоящее время делать заключения относительно свойств, устойчивости элементов и которая позволяет увеличивать ещё в большей степени их число.
Атомы
При нашем рассмотрении материального мира мы подошли к элементам и обозначили этим термином наипростейшие неразложимые химическим путём вещества. Но уже возникает перед нами новый вопрос. А возможно ли разложить дальше элементы каким-либо иным путём, и если возможно, то в какой мере и с каким результатом?
До каких пределов можно делить гвоздь?
Разумеется, при этом мы должны будем исключить химические процессы, ибо таким путём элементы, как мы уже знаем, не поддаются дальнейшему разложению. Но механическое разделение элементов должно быть, несомненно, осуществимым, ибо, например, можно разделить гвоздь, состоящий из одного только элемента, на более мелкие куски. Если мы будем продолжать этот процесс деления в течение достаточно долгого времени, то эти кусочки сделаются, наконец, столь малыми, что их уже нельзя больше захватить пальцами, и даже острота зрения окажется уже недостаточной, чтобы различить их. Путём применения оптических инструментов, как например лупы, ультрамикроскопа и, наконец, электронного микроскопа, а равно с помощью пинцетов и других разделительных приборов эти маленькие частицы можно было бы разделять ещё дальше, однако в конце концов при этом мы дошли бы совершенно несомненно до границы, поставленной несовершенством человеческого умения и несовершенством приборов.
Мысленно мы могли бы продолжить этот процесс разделения, но в конце концов нам необходимо ответить себе на вопрос: доколе такое разделение окажется возможным? Можно ли снова разделить пополам кусочек железа, который за это время стал уже ничтожно малым, или мы придём, наконец, к пределу, в котором самое понятие «ещё более мелкий кусочек железа» потеряет свой смысл? Если мы к решению этого вопроса подойдем без учёта современных научных достижений, то на этот вопрос мы не сумеем ответить ни положительно, ни отрицательно. Дело в том, что если мы решимся сделать предположение, что такое разделение всё ещё является возможным (по крайней мере мысленно), то ведь при этом наш кусочек железа сделался бы бесконечно малым, а вместе с понятием «бесконечно малый» выплывают новые затруднения. Если мы в наших рассуждениях дойдём до этого вывода, то для нас начинает становиться более наглядной другая точка зрения: когда-нибудь мы подойдём к последнему кусочку железа, который уже более невозможно разделить, ибо при дальнейшем его разделении образовавшиеся кусочки уже нельзя будет назвать железом. Во всяком случае, и это снова огорчает нас, высказанное предположение невозможно будет таким путём доказать.
Предел делимости вещества. Исторический аспект
Предположение о том, что где-нибудь существует предел делимости, не является для нас, непосредственно понятным. Где же должна быть эта граница, почему у этой границы становится невозможным дальнейшее дробление железа? Ведь какой-нибудь предмет, как бы мал он ни был, согласно нашим представлениям возможно без конца делить пополам.
Такие же сомнения, вероятно, испытывали ионийские натурфилософы, когда они размышляли на эту тему. Что разделение вещества возможно и происходит, в этом они могли убедиться из ежедневного опыта. Так, они могли наблюдать, что золотые кольца при постоянном их употреблении становятся все тоньше и тоньше, что капли воды, непрерывно падая на одно и то же место, долбили камень. Несомненно, при этих процессах должны были всё время стираться мельчайшие частицы, которые уже были неуловимы для органов чувств человека.
Ввиду того что им не было доступно понятие о бесконечности, они пришли к предположению, что материальный мир построен из мельчайших неделимых атомов (греч. «атомос»—неделимый). По крайней мере мы знаем, что Лейкипп и Демокрит были основоположниками и главными защитниками этого учения. По их представлениям атомы являются неизменными, неделимыми, различными (в зависимости от того или иного вещества) по величине и по форме частицами, которые вследствие своей ничтожной величины не могут быть обнаружены нашими органами чувств.

Однако не только вещество, но и огонь, а также душа состоит, как они думали, из атомов, но только в этих случаях атомы по своей лёгкости и подвижности отличаются от прочих атомов. Все атомы находятся в состоянии непрерывного движения и при своих столкновениях и обратных расхождениях вступают в процессы образования вещества и его превращения.
В этом учении мы, несомненно, не можем не усмотреть материалистического зерна. Поэтому оно находилось в противоречии с позднейшими христианскими воззрениями, проповедовавшими планомерную, руководимую извне действительность. Поэтому вполне понятным является то обстоятельство, что учение об атомах не встретило признания в течение позднейших столетий и что были сделаны попытки искоренить это учение огнём и мечом, т.е. путём сожжения излагавших это учение сочинений и самих авторов этих сочинений. Таким путём, правда, был достигнут лишь тот результат, что мы располагаем в настоящее время только отрывками сочинений Лейкиппа и Демокрита и узнаём об их учении главным образом из сочинений их противников, но таким образом никогда не могло быть искоренено атомное учение или материалистическое мировоззрение.
Открытие атома
Вплоть до начала XIX века атом был не больше, чем гипотезой, для которой ещё не существовало точного естественнонаучного обоснования. Эта гипотеза выплывала то в одном, то в другом случае в представлениях некоторых естествоиспытателей, но она не могла окончательно утвердиться вследствие своего гипотетического характера, а также вследствие своего материалистического зерна.
Положение это изменилось лишь в 1804 году, когда англичанину Джону Дальтону существование атомов оказалось прямо-таки необходимым для объяснения результатов его экспериментов. Правда, и теперь атом ещё не удалось увидеть и осязать, но его реальное существование сделалось рабочей гипотезой. Признание существования атомов становилось прямо-таки необходимым требованием при желании объяснить некоторые явления, хотя при этом и не удавалось однозначно доказать их фактическое существование. Но если во времена Дальтона атомы ещё оставались не более чем гипотезой, то в течение следующих десятилетий в пользу их существования было накоплено так много доказательств, что мы в настоящее время уже без всякого сомнения должны считать их реальностью.
Каким образом Дальтон подошел к своему требованию признания существования атомов?
Закон постоянных весовых отношений Дальтона
При его исследованиях, касавшихся соединительных весов разных элементов, он сделал поразительное открытие. Два или большее число элементов вступают во взаимодействие всегда в совершенно определённых неизменных весовых отношениях. Поясним это примером. Соединение серы с железом называется сернистым железом. При взаимодействии обоих элементов, с образованием сернистого железа, при котором после реакции не останется избытка ни того, ни другого из участвующих в реакции веществ, отношение весов серы и железа, содержащихся в сернистом железе, будет равно 4 весовым частям серы к 7 весовым частям железа. Таким образом, во взаимодействие вступают 4 г серы с 7 г железа, или 8 кг серы с 14 кг железа, или другие соответствующие количества обоих элементов в указанном количественном отношении. Но всегда отношение 4:7 будет при этом соблюдаться. Равным образом и при разложении соединения сернистого железа на серу и железо будут появляться такие количества свободных серы и железа, которые опять-таки будут относиться как 4:7.
Для иных соединений обнаружились другие количественные соотношения, но всегда количества элементов, вступающих друг с другом без остатка в соединение, выражались целыми и относительно небольшими числами, Дальтон назвал этот вывод законом постоянных весовых отношений. Как можно было объяснить эти экспериментальным путем найденные факты? Ввиду того что эти постоянные отношения были обнаружены во всех случаях, они ни в коем случае не могли быть случайными: основой этих чисел, выражающих отношение количеств вступающих в реакцию веществ, должны были служить какие-нибудь реальные факты.
По-видимому, заключил Дальтон, каждый элемент состоит из мельчайших одинаковых между собой частиц, а именно — из атомов. Эти, атомы характеризуются определенным весом, который для атомов одного и того же элемента должен быть, разумеется, одинаковым и характерным именно для данного элемента. Если один, два или несколько элементов вступают во взаимодействие, то это осуществляется таким образом, что всегда целые атомы соответствующих элементов взаимодействуют друг с другом с образованием новой единицы — молекулы.
И если атом серы имеет атомный вес 32, а железо — атомный вес 56, то при образовании сернистого железа каждый атом серы должен соединиться с атомом железа с образованием одной молекулы сернистого железа, которая будет иметь вес 32 плюс 56, т.е. 88. Как можно видеть, сера и железо содержатся в этой молекуле в количественном отношении 32:56 или после сокращения 4:7. Мы, следовательно, приходим таким образом к прежнему отношению. Ввиду того что соединение сернистое железо состоит из одних только одинаковых между собой молекул, это весовое отношение сохранится и для характеристики каждой молекулы.
Благодаря предположению, что элементы состоят из атомов, а соединения из молекул, закон постоянных весовых отношений Дальтона получает очень простое и понятное объяснение. Атомы уже перестают быть чисто умозрительными представлениями, возникшими на основании философских спекулятивных рассуждений, но они становятся необходимым вспомогательным средством для истолкования экспериментально найденных закономерностей.
Таким образом, Дальтон уверенно ввёл атомы в естествознание, и на протяжении следующих десятилетий учёные начинают обращаться с атомами, как с реальностью. Однако и здесь дело не обошлось без затруднений. Приблизительно в конце XIX века всё же некоторые химики и физики придерживались того мнения, что атомы хотя и могут и даже должны быть привлечены к разъяснению многих явлений, но всё же их существование ещё остается сомнительным. Бухерер считал, что атомистика необходима в качестве основы при возведении постройки научной теории, но что после возведения этой постройки атомистика снова должна непременно быть разрушена. Такие точки зрения станут понятными, если мы будем иметь в виду, что атомы были привлечены для объяснения некоторых явлений, которые протекали «как бы» таким образом, если бы вещества действительно состояли из атомов. Когда кто-нибудь отправляется купаться и выплывает в море, но не возвращается назад, то я могу предполагать, что он при этом утонул, однако своё предположение, как бы обоснованно оно ни было, я не сумею представить как доказательство.
Вопрос о том, существуют ли атомы или нет, был окончательно решен в течение следующих десятилетий и решен в пользу атомного учения Дальтона. Успехи атомной физики окончательно рассеяли все сомнения, и в эпоху, когда наука занимается вопросом об использовании атомной энергии, уже никто больше не сомневается в существовании атомов. Однако и тем лицам, которые считают, что они могут верить лишь тому, что увидят собственными глазами, можно сказать, что при помощи электронного микроскопа можно непосредственно наблюдать молекулы.
Литература:
З. Шпаусус. Путешествие в мир химии. М.: Государственное учебно-педагогическое издание министерства просвещения РСФСР, 1959